
离子通道是细胞膜上的具有亲水孔道的一类疏水膜蛋白,能选择性通透不同离子(如:K+,Na+,Ca2+,Cl-等)。随着跨膜离子流动而使得通道所在膜两边的跨膜电位发生变化,进而实现神经传导,肌肉收缩,或细胞内外离子平衡。电压门控离子通道的孔道开放与关闭受细胞膜两边的膜电位调节。不同离子通道受膜电位影响的方式不一样,包括去极化(depolarization膜内电压高于膜外电压) 或超极化(hyperpolarization膜外电压高于膜内电压)调节。
钾离子是植物生命过程中的关键元素,在植物的生长发育及各种生理过程中起至关重要的作用。植物利用细胞膜表面的钾离子通道进行钾离子吸收或者外排,从而维持体内钾平衡并实现生理功能调节。KAT1是表达于拟南芥叶片气孔保卫细胞(guard cell)中的钾离子通道。研究表明KAT1是一种电压门控的内向整流钾离子通道,介导K+内流,引起气孔膨胀和开放,在调节植物叶片表面气孔孔隙变化中起关键作用。
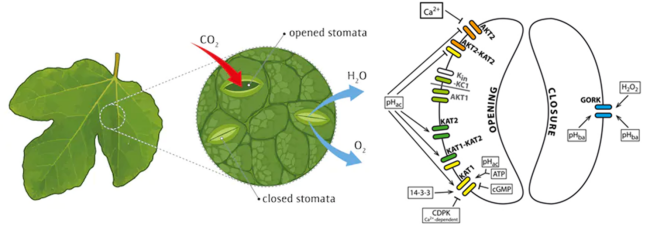
KAT1属于一种较为罕见的超极化激活-内向整流离子通道(hyperpolarization inward rectifying K+ channel)。与典型的去极化激活K +通道相比,KAT1具有独特的反向电压依赖性:去极化导致通道关闭,超极化导致通道开放,并开放K+向内流动(高等动物中电压门控K+通道通常为外向整流K+离子通道)。目前,超极化激活的内向整流离子通道的研究非常少,其独特门控特性的结构机制仍然不够清楚。
2020年9月8日,中国科学技术大学田长麟课题组在Cell Research在线发表题为“Cryo-EM structure of the hyperpolarization-activated inwardly rectifying potassium channel KAT1 from Arabidopsis”的研究论文,该研究报告了来源于拟南芥的超极化内向整流钾离子通道KAT1的冷冻电镜结构,整体分辨率为3.2 Å。KAT1的结构是目前报道的第一个来源于植物的钾离子通道结构。
KAT1冷冻电镜结构表明KAT1具有典型的“非结构域交换(non-domain-swapped)”的拓扑结构,这与来源于动物的Eag (Kv10.1),hErg (Kv11.1),HCN1等通道具有较高的结构相似性,而与Kv1.2, Nav, Cav等通道的拓扑结构存在较大差别。KAT1具有由Thr-Thr-Gly-Tyr-Gly等氨基酸构成的K+离子选择过滤器(selectivity filter),以及由(RIL)(SML)(RLW)(RLR)(RVS)等氨基酸构成的电压感受器(voltage sensor),符合经典的钾离子通道结构特征。通过与Kv1.2, Eag, hErg以及HCN1等离子通道进行结构比较发现,作为电压感受器的S4跨膜螺旋自身并不决定KAT1的超极化激活。

结合KAT1的膜片钳电生理和KAT1冷冻电镜结构数据表明,KAT1的S4, S5跨膜螺旋之间的linker结构与S6螺旋后端的C-linker结构之间存在较为稳定的相互作用,在超极化条件下,S4螺旋向细胞膜内滑动,推动S6螺旋,进而打开通道。该工作揭示了KAT1与经典钾离子通道之间的结构相似性以及差异,为阐明离子通道的门控机制,特别是超极化激活的内向整流K+通道的物理化学机制提供了新的线索。

本工作由中国科学技术大学生命学院博士研究生李思宇,杨帆,张勇及特任副研究员孙德猛等共同完成,田长麟教授,张隆华副教授,孙德猛特任副研究员指导本项工作,并作为本文的共同通讯作者。本研究工作得到了国家自然科学基金,科技部重大研究计划,科学院先导专项等的经费支持。值得一提的是,本项工作还在评审期间,芝加哥大学Eduardo Perozo课题组5月27日在Nature发表了同一个蛋白的冷冻电镜结构,并揭示与本项工作类似的超极化激活机制 (https://doi.org/10.1038/s41586-020-2335-4)。本项工作经过评审后,于8月14日被国内杂志Cell Research接收,9月8日公开发布(https://www.nature.com/articles/s41422-020-00407-3#accession-codes)。
(合肥微尺度物质科学国家研究中心,生命科学与医学部,科研部)
