教育部细胞动力学重点实验室联合攻关团队的工作以“Structural insights into human CCAN complex assembled onto DNA”为题,发表在Cell Discovery杂志。
细胞精确的自我复制是其生活史的重要组成部分。在细胞复制过程中,包含在染色体中的父代遗传信息在经历诸多复杂的运动后,均等地传递给两个子细胞。着丝粒是一个由多个蛋白质机器组成的细胞器,在细胞有丝分裂过程中衔接染色体与纺锤体微管的结合,进而调控染色体的正确分离【1-2】。着丝粒结构与组装异常导致染色体丢失、易位等,从而使细胞生长失控,促进癌症的产生与发展。着丝粒组装可塑性调控是细胞增殖、个体发育与物种繁衍的基础,是细胞生物学、表观遗传学及蛋白质机器的研究热点,30多年方兴未艾。针对着丝粒组装与调控相关蛋白质机器的研究,不仅为揭示细胞命运抉择本质,也为解析个体发育、疾病发生与发展的分子机制提供更为详实的证据。
哺乳动物细胞着丝粒含有四层超微精细结构,约含有150余种蛋白质。着丝粒其内层主要是CENP-A核小体及CCAN(constitutive centromere-associated network)复合物组成的特异性的染色质层,在其基础上组装的着丝粒外层KMN网络介导了细胞有丝分裂过程中染色体与着丝粒的衔接【3,4】。由于大部分着丝粒蛋白含有低复杂度区域,解析高分辨着丝粒蛋白质三维结构一直是染色体生物学与表观遗传结构生物学的重大技术挑战。为此,着丝粒内层的详尽分子构成、着丝粒区域的核小体特征及着丝粒组装蛋白识别的结构基础信息的缺乏制约了着丝粒可塑性的功能解析。
伴随漫长的生物进化过程,着丝粒从低等真核细胞芽殖酵母的点状结构演进成为更为复杂的人类细胞区域性结构【4】。自从2019年芽殖酵母的点状着丝粒(point centromere)内层结构的——CENP-A核小体-CCAN复合物的结构公布之后【5】,解析区域性着丝粒(regional centromere)与点状着丝粒分子构架与调控机制的异同成为了领域迫在眉睫的重要科学问题。事实上,多个国际顶尖结构生物学实验室在过去的20年间试图挑战人源CCAN蛋白复合体的结构与功能相关性解析,但是一直未获得成功。由细胞动力学教育部重点实验室臧建业、孙林峰与姚雪彪组成的联合攻关团队,经过5年的不懈探索,成功地组装了由CENP-C、CENP-LN、CENP-HIKM、CENP-TWSX、CENP-OPQUR 5个亚复合物组装而成的CCAN复合物。
利用冷冻电镜单颗粒分析技术、生物化学鉴定与细胞功能评估,他们解析了人源CCAN复合物的组装模式、亚复合物构架关联以及各分子结合的界面信息。他们发现CENP-LN、CENP-HIKM、CENP-OPQUR、CENP-TWSX共同形成一个“隧道”,拓扑学地包围着丝粒DNA(图1)。在此结构中,CENP-LN异二聚体构成了隧道的“拱顶”,通过多个带正电的氨基酸残基与DNA结合。CENP-TWSX复合物中的多个带正电的氨基酸残基,亦可以结合DNA,形成类核小体结构。此外,CENP-C既可以结合CENP-LN,又可以结合CENP-HIKM,表明CENP-C在CCAN的组装中具有重要的地位,提示它可以指导CCAN复合物的组装。

图1:CCAN复合物与着丝粒DNA结合形成多价态作用模式
CENP-A核小体-CCAN复合物结构的解析,改变了以往人们对着丝粒组装的认知。此前,该研究团队与国际同行的研究发现CENP-N蛋白通过其氨基端结合CENP-A的RG-loop【6】,从而招募CCAN其他亚复合物在着丝粒的上传与组装【7-9】。在此项研究中,通过结构比较CENP-LN-CENP-A核小体的结合模式与CCAN-CENP-A核小体的结合模式,发现组装后的CCAN复合物则通过与着丝粒DNA结合形成多价态作用模式,而不再与CENP-A结合。突变CENP-LN与DNA的结合界面会导致其着丝粒定位减弱与细胞有丝分裂染色体排列异常(图2),提示CENP-LN与DNA的动态结合是细胞有丝分裂期染色体运动的重要结构基础。为此,组装成熟后的CCAN复合物主体并不直接结合CENP-A核小体,而是锚定在核小体之间的连接DNA上,形成“套环”式“隧道”结构锁住DNA(图3)。
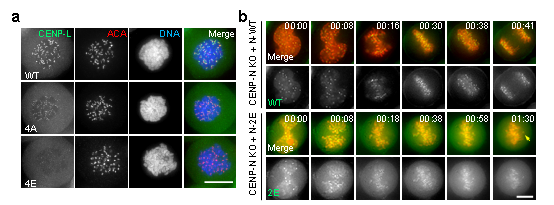
图2:CENP-LN与DNA的动态结合是细胞有丝分裂期染色体运动的重要结构基础
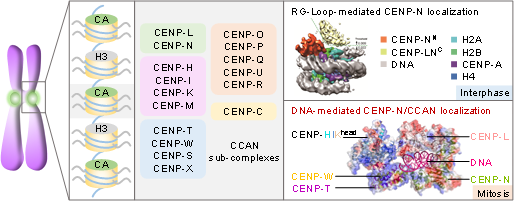
图3:CENP-N的通过变构效应调控CCAN的组装与DNA结合
基于系统性构-效分析,该研究团队首次提出了着丝粒核心蛋白质复合物CCAN与DNA拓扑缠绕的多价态结合模式有利于着丝粒结构的稳定,为我们理解在染色体运动过程中着丝粒如何能够承受纺锤体微管的拉力提供了新的工作模式。目前,他们正在解析CCAN组装过程中的变构机制与翻译后修饰如何改变CCAN分子动力学特征。
值得一提的是,CCAN的构效解析是染色体生物学、表观遗传学与细胞生物学的核心科学问题。围绕此重大科学问题,美国NIH、Harvard、MIT、Stanford,德国Max Planck Institute,英国MRC等科研攻关团队在着丝粒构-效关联研究方面做了长期的探索。在本研究发表过程中,英国MRC的Barford团队和德国MPI的Musacchio团队也分别报道了CCAN复合物的冷冻电镜精细结构【10-11】。三项独立研究解析的CCAN复合物结构高度一致,仅细节略有不同,相互印证了CCAN复合物具有广泛的DNA结合界面。为此,新解析的CCAN复合物结构与功能草图为系统理解人类着丝粒复合物在有丝分裂过程的动态重构以及染色体区室化的调控模式提供了新工具与范式。
田甜副研究员、博士研究生陈丽丽、窦震副教授、博士研究生杨智森为该论文的第一作者。姚雪彪教授、臧建业教授、孙林峰教授与高新娇副研究员为本论文的共同通讯作者。该工作获得国家自然科学基金委、科技部、中国科学院与教育部的鼎力支持。
论文链接:
https://www.nature.com/articles/s41421-022-00439-6
参考文献
1. Santaguida, S. and Amon, A. Short- and long-term effects of chromosome mis-segregation and aneuploidy.Nat Rev Mol Cell Biol. 16: 473-85. (2015).
2. McKinley, K.L. and Cheeseman, I.M. The molecular basis for centromere identity and function.Nat Rev Mol Cell Biol. 17: 16-29. (2016).
3. Suzuki, A. et al. The architecture of CCAN proteins creates a structural integrity to resist spindle forces and achieve proper intra-kinetochore stretch.Dev Cell. 30: 717-30. (2014).
4. Liu, X. et al. Phase separation drives decision making in cell division.J Biol Chem.295: 13419-13431. (2020).
5. Yan, K.et al. Structure of the inner kinetochore CCAN complex assembled onto a centromeric nucleosome.Nature. 574: 278-282. (2019).
6. Tian, T. et al. Molecular basis for CENP-N recognition of CENP-A nucleosome on the human kinetochore.Cell Res. 28: 374-378. (2018).
7. Pentakota, S. et al. Decoding the centromeric nucleosome through CENP-N.eLife.6: e33442. (2017).
8. Chittori, S. et al. Structural mechanisms of centromeric nucleosome recognition by the kinetochore protein CENP-N.Science.359: 339-343. (2018).
9. Fang, J. et al. Structural transitions of centromeric chromatin regulate the cell cycle-dependent recruitment of CENP-N.Genes Dev. 29: 1058-1073. (2015).
10. Yatskevich, S. et al. Structure of the human inner kinetochore bound to a centromeric CENP-A nucleosome.Science. 376: 844-852. (2022).
11. Pesenti, M.E. et al. Structure of the human inner kinetochore CCAN complex and its significance for human centromere organization.Mol Cell.82: 2113-2131. (2022).
12. Tian et al.Structural insights into human CCAN complex assembled onto DNA.CellDisc8: 90. (2022).
(细胞动力学教育部重点实验室、科研部)
