中国科学技术大学生命科学学院张华凤课题组、高平课题组与中山大学宋立兵等课题组合作,发现营养缺乏条件下的肝癌细胞通过代谢重编程激活酮体产能而促进肿瘤的发生发展。研究成果以“Hepatocellular carcinoma redirects to ketolysis for progression under nutrition deprivation stress”为题,于9月20日在线发表于《Cell research》杂志(影响因子:14.812)。来自法国国家健康与医学研究院(INSERM)的著名肿瘤学家、欧洲科学院院士Guido Kroemer博士在同一期杂志中对相关成果进行了专题述评。
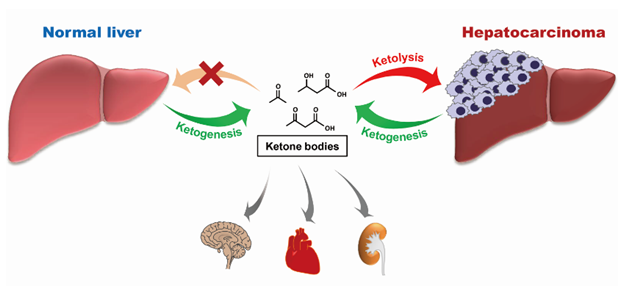
众所周知,在人体饥饿时肝脏能够快速氧化分解脂肪酸生成乙酰辅酶A,进一步合成酮体对大脑、肌肉、肾脏等重要的耗能器官提供快速高效的能量供应。为了避免无效循环,肝细胞中缺乏分解酮体的酶OXCT1,因此肝脏不能利用酮体。本项研究发现,不同于正常肝脏细胞,肝癌细胞在血清饥饿时能够激活OXCT1表达,并分解外源酮体进行代谢。血清饥饿通过调控mTORC2-AKT-SP1通路激活OXCT1的转录表达,进而促进外源酮体向肝癌细胞供给能量,帮助肝癌抵抗营养压力所导致的细胞自噬。通过外源酮体注射实验,证明高血酮小鼠能进一步促进OXCT1高表达的肝癌细胞在体内的生长。进一步临床研究发现,人肝癌组织中的OXCT1表达远远高于相应的癌旁组织,且OXCT1的表达量与肝癌病人预后呈负相关关系。此项研究不仅在理论上揭示了肿瘤细胞通过改变代谢特点和代谢方式以适应恶劣营养压力的新机制,并且为治疗肝癌提供了新的潜在靶点,对于肝癌的临床研究具有重要的指导意义。
论文的共同第一作者为张华凤课题组的黄的和李婷婷。该研究工作还得到了厦门大学林圣彩教授、安徽省立医院荚卫东教授以及美国宾夕法尼亚大学Chi Dang教授等课题组的大力协助。该项研究是在国家科技部、自然科学基金委、中科院的资助下完成的。
论文链接: http://www.nature.com/cr/journal/vaop/ncurrent/full/cr2016109a.html
